Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 6. A và B là các nguyên tố:
Al và Br.
Al và Cl.
Si và Cl.
Si và Ca.
Phương pháp: Viết cấu hình e của nguyên tử nguyên tố A sao cho tổng số e trong phân lớp p bằng 8. => ZA => A Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 => ZB => số hiệu nguyên tử của B => B Hướng dẫn giải: Cấu hình nguyên tử nguyên tố A là: ![]() ZA = 14 => A là Si Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 hay ZB – ZA = 3 => ZB = 17 => B là Cl.
ZA = 14 => A là Si Số hạt mang điện của B nhiều hơn số hạt mang điện của A là 6 => 2ZB – 2ZA = 6 hay ZB – ZA = 3 => ZB = 17 => B là Cl.
Vậy đáp án đúng là C.

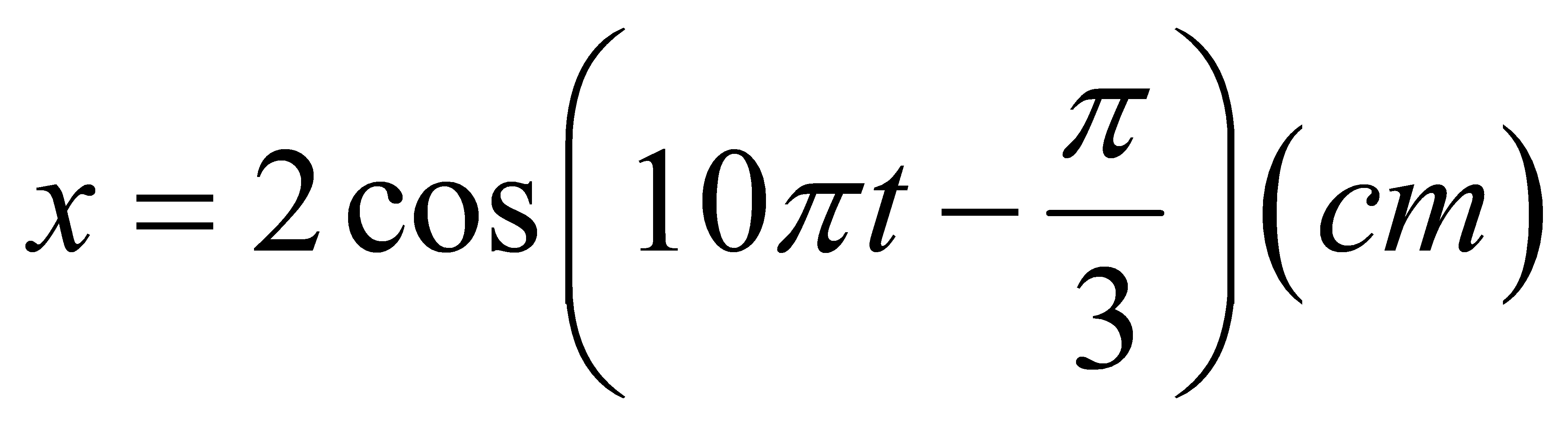 . Lần thứ 10 mà vật dao động có li độ x = -1cm và đang tiến về vị trí cân bằng là vào thời điểm:
. Lần thứ 10 mà vật dao động có li độ x = -1cm và đang tiến về vị trí cân bằng là vào thời điểm: 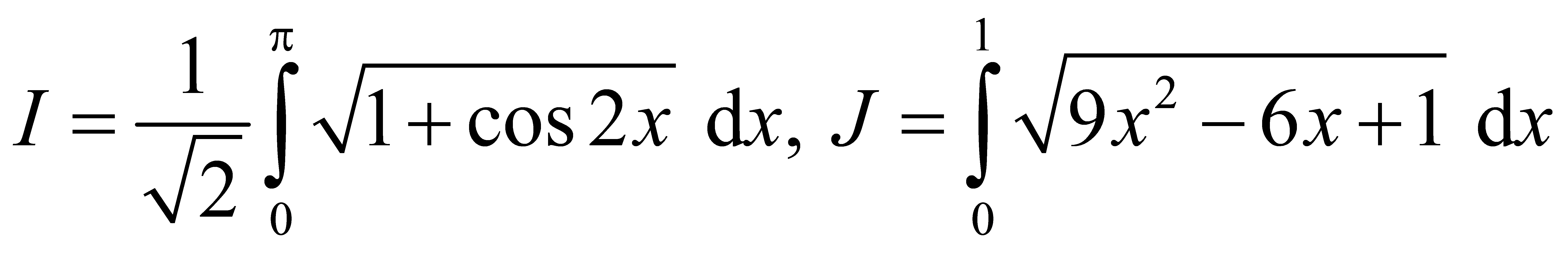 . Khẳng định nào sau đây là khẳng định đúng?
. Khẳng định nào sau đây là khẳng định đúng?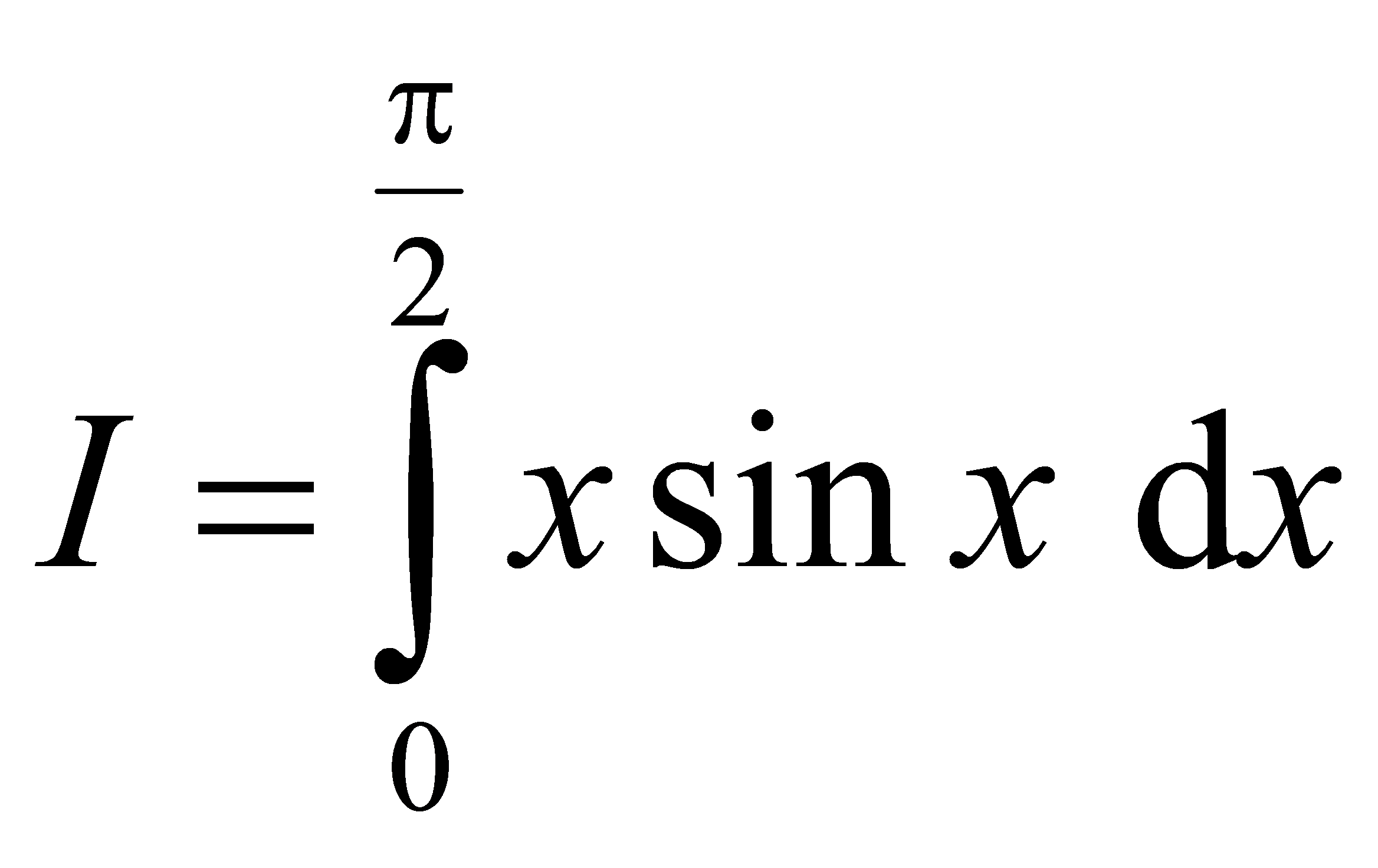 .
.