Cho hỗn hợp T gồm 2 axit đa chức A, B và 1 axit đơn chức C ( số cacbon trong các chất không vượt quá 4 và chúng đều mạch hở, không phân nhánh ). Chia hỗn hợp thành 3 phần bằng nhau :
Phần 1: Cho tác dụng dung dịch NaOH dư thì thấy có 1,02 mol NaOH phản ứng,
Phần 2: Đem đốt cháy trong Oxi dư thì thu được V lít CO2 và 14,04 gam nước.
Phần 3: Cho tác dụng với dung dịch AgNO3 dư thu được 104,76(g) kết tủa.
Biết số mol của CO2 lớn hơn 2 lần số mol Nước và số mol của A và B bằng nhau.
Giá trị V gần nhất với :
Đầu tiên ta nhìn thấy 1 điều đặc biệt rằng, 2 axit đa chức kia bản chất là 2 axit 2 chức !
Hỗn hợp axit T có thể phản ứng với \(AgN{O_3}\) sinh ra kết tủa. Mà axit 2 chức mạch hở thì không thể tác dụng được với . Vậy kết hợp với giả thiết “số cacbon trong các chất không vượt quá 4” thì axit đơn chức chỉ có thể là:
\(\left[ \begin{array}{l}
HCOOH(1)\\
CH \equiv C - COOH(2)\\
CH \equiv C - C{H_2} - COOH(3)
\end{array} \right.\)
Trường hợp 1 : HCOOH \( \to {n_{HCOOH}} = \frac{1}{2}{n_{Ag}} = 0,485(mol)\)
\(\begin{array}{l}
\to {n_{ - COOH(A,B)}} = 1,02 - 0,485 = 0,535(mol)\\
\to {n_{A,B}} = \frac{1}{2}{n_{ - COOH(A,B)}} = 0,2675(mol)
\end{array}\)
\( \to {n_{C{O_2}(MAX)}} = 4.0,2675 + 0,485 = 1,555(mol) < 2.{n_{{H_2}O}} = 1,56(mol)\) ( Loại )
Trường hợp 2 : \(CH \equiv C - COOH\) ![]()
\( \to \downarrow :CAg \equiv C - COON{H_4} \to {n_{CH \equiv C - COOH}} = \frac{{104,76}}{{194}} = 0,54(mol)\)
\( \to {n_{ - COOH(A,B)}} = 1,02 - 0,54 = 0,48(mol) \to {n_{A,B(R{{(COOH)}_2})}} = \frac{1}{2}.0,48 = 0,24(mol)\)
\({n_{{H_2}O(A,B)}} = 0,78 - 0,54 = 0,24(mol)\)
\( \to {\overline H _{A,B}} = 2 \to A,B\underbrace {\left\{ \begin{array}{l}
{(COOH)_2} - 0,12(mol)\\
HOOC - C \equiv C - COOH - 0,12(mol)
\end{array} \right\}}_{0,24(mol)}\)
\( \to {n_{C{O_2}}} = 0,12.2 + 0,12.4 + 0,54.3 = 2,34(mol) \to V = 52,416(l) \to B\)

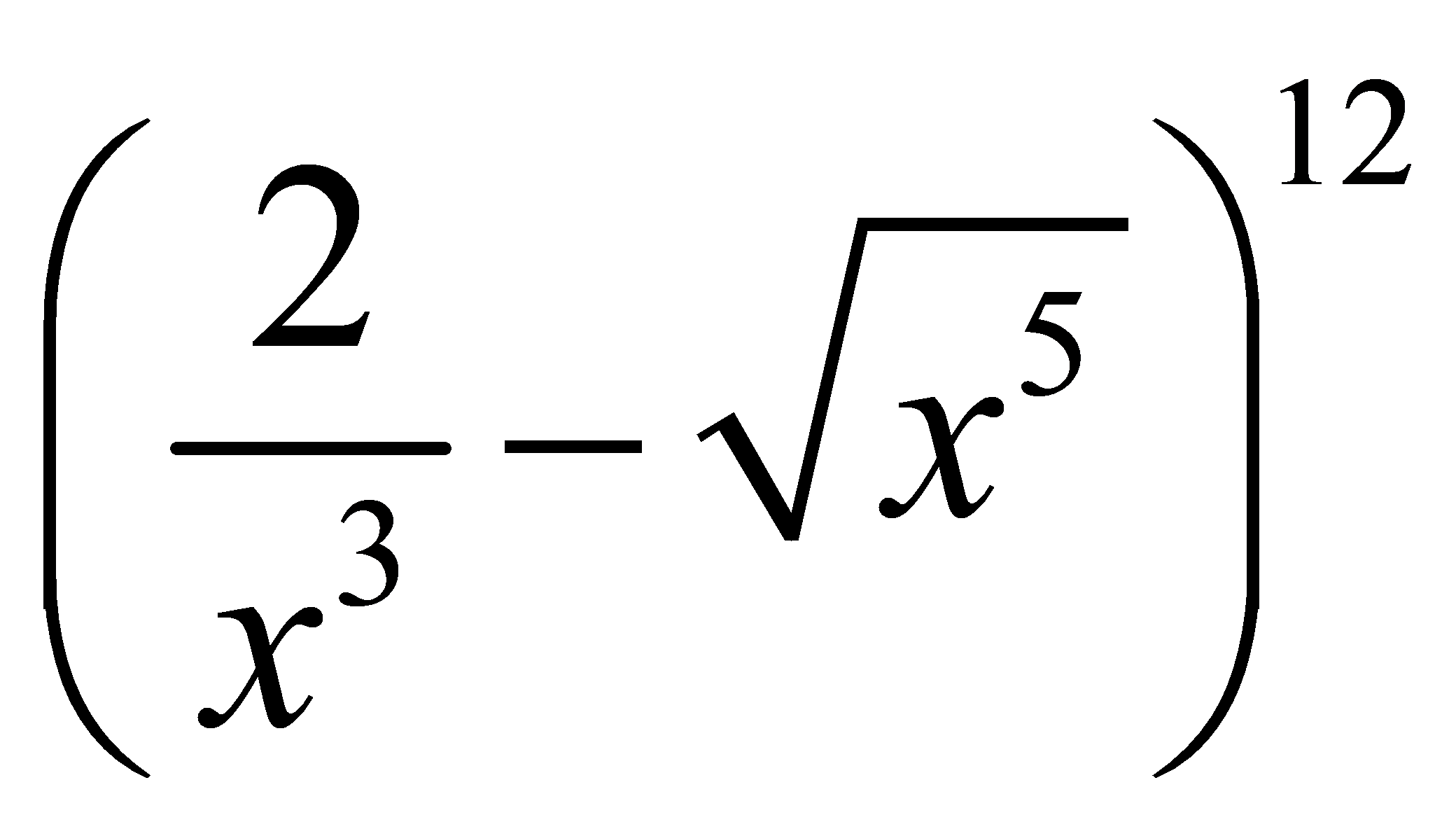 với
với 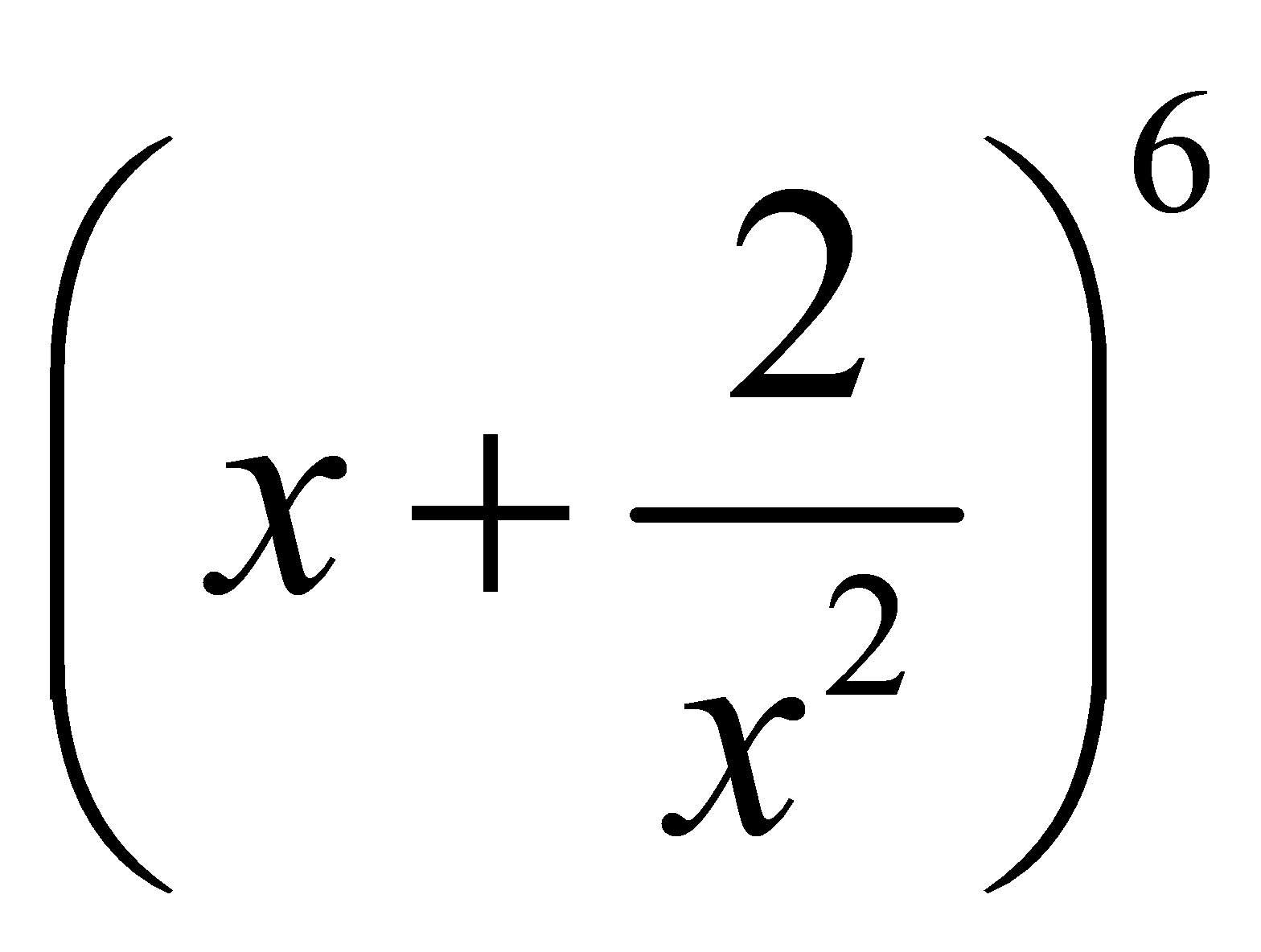 bằng:
bằng: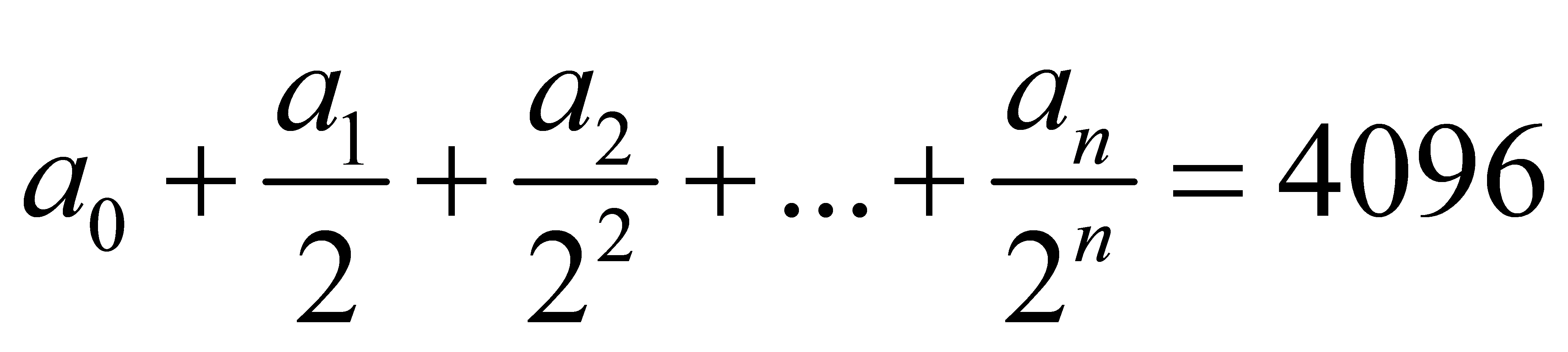 . Số lớn nhất trong các số
. Số lớn nhất trong các số 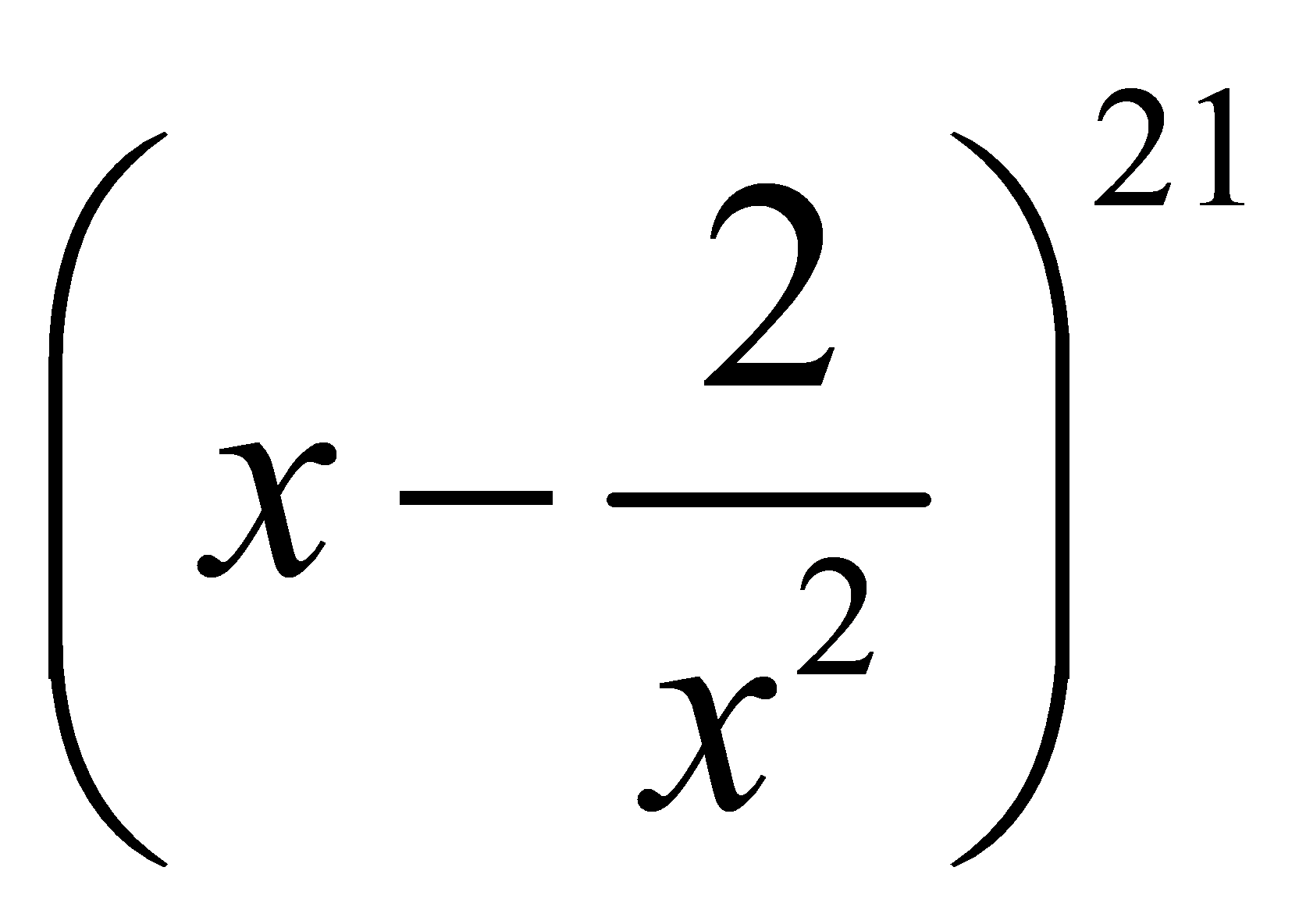 ,
,