Dung dịch natri benzoat (C6H5COONa) có nồng độ 2.10-5 và Ka(C6H5COOH) = 6,29.10-5 có pH là bao nhiêu?
6,94
A.A.
B.B.
7,06
C.C.
9,3
D.D.
8,04
Đáp án và lời giải
Đáp án:B
Lời giải:
C6H5COONa → C6H5COO- + Na+
C6H5COO- + H2O ⇔ C6H5COOH + OH-
Kb (C6H5COO- )= 10-14 : Ka = 1,59.10-10
Kb.Cb < 2.10-13 ⇒ Tính cả sự điện li của H2O
Ta có: [OH-]3 + Kb.[OH-]2 – (10-14 + Kb.Cb).[OH-] – 10-14.Kb = 0
⇒ [OH-] = 1,146.10-7 ⇒ pH = 14 – pOH = 7,06
⇒ Đáp án B

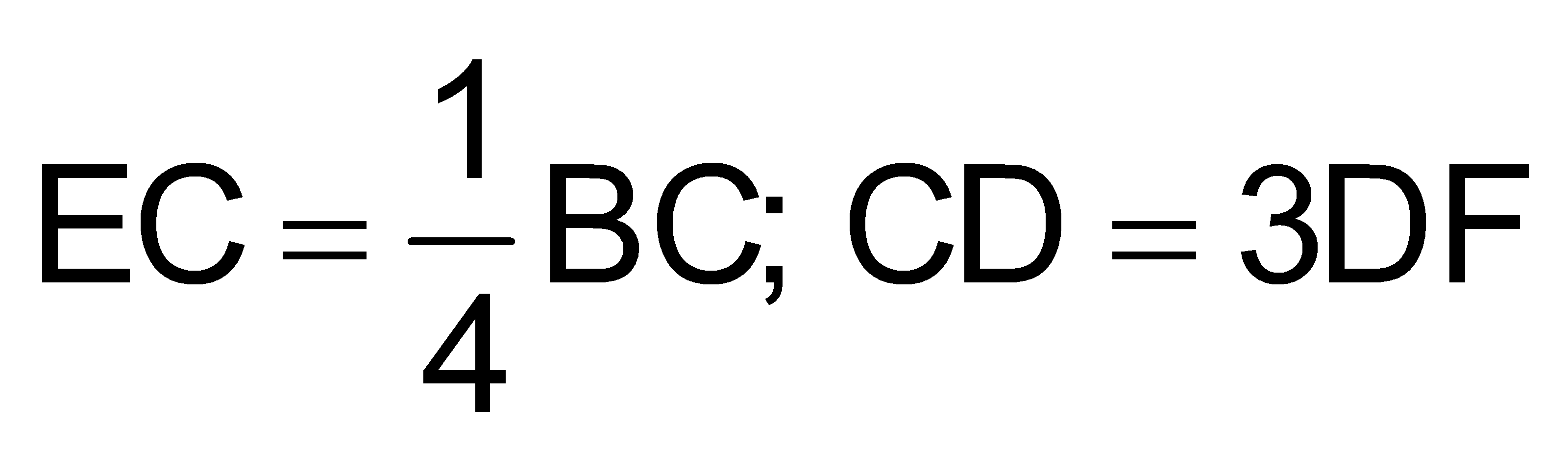 . Gọi G là một điểm trên AD (G không trùng với A hoặc D) sao cho GF không song song với AC. Mệnh đề nào sau đây đúng?
. Gọi G là một điểm trên AD (G không trùng với A hoặc D) sao cho GF không song song với AC. Mệnh đề nào sau đây đúng?