Hòa tan hoàn toàn 21,5 gam hỗn hợp X gồm Al, Zn, FeO và Cu(NO3)2 cần dùng vừa đủ 430 ml dung dịch H2SO4 1M, thu được hỗn hợp khí Y gồm 0,06 mol NO và 0,13 mol H2; dung dịch Z chỉ chứa các muối sunfat trung hòa (không chứa muối Fe3+). Cô cạn Z, thu được 56,9 gam muối khan. Phần trăm khối lượng của Al trong X có giá trị gần nhất với giá trị nào sau đây?
- Khi cho 21,5 gam X tác dụng với 0,43 mol H2SO4 thì:
BTKL: \({n_{{H_2}O}} = \frac{{{m_X} + 98{n_{{H_2}S{O_4}}} - 30{n_{NO}} - 2{n_{{H_2}}} - {m_Z}}}{{18}} = 0,{26^{mol}}\)
BTNT.H: \({n_{N{H_4}^ + }} = \frac{{2{n_{{H_2}S{O_4}}} - 2{n_H}_{_2O} - 2{n_{{H_2}}}}}{4} = 0,{02^{mol}}\)\( \Rightarrow {n_{Cu{{(N{O_3})}_2}}} = \frac{{{n_{N{H_4}^ + }} + {n_{NO}}}}{2} = 0,{04^{mol}}\)
Ta có: nO(trong X) = nFeO = \(\frac{{2{n_{{H_2}S{O_4}}} - 10{n_{N{H_4}^ + }} - 4{n_{NO}} - 2{n_{{H_2}}}}}{2}\)
Trong X có: \(\left\{ \begin{array}{l} 3{n_{Al}} + 2{n_{Zn}} = 3{n_{NO}} + 2{n_{{H_2}}} + 8{n_{N{H_4}^ + }} = 0,6\\ 27{n_{Al}} + 65{n_{Zn}} = {m_X} - 72{n_{FeO}} - 188{n_{Cu{{(N{O_3})}_2}}} = 8,22 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} {n_{Al}} = 0,{16^{mol}}\\ {n_{Zn}} = 0,{06^{mol}} \end{array} \right.\)
⇒ %mAl = 20,09%

 . Thu gọn M được kết quả là:
. Thu gọn M được kết quả là: 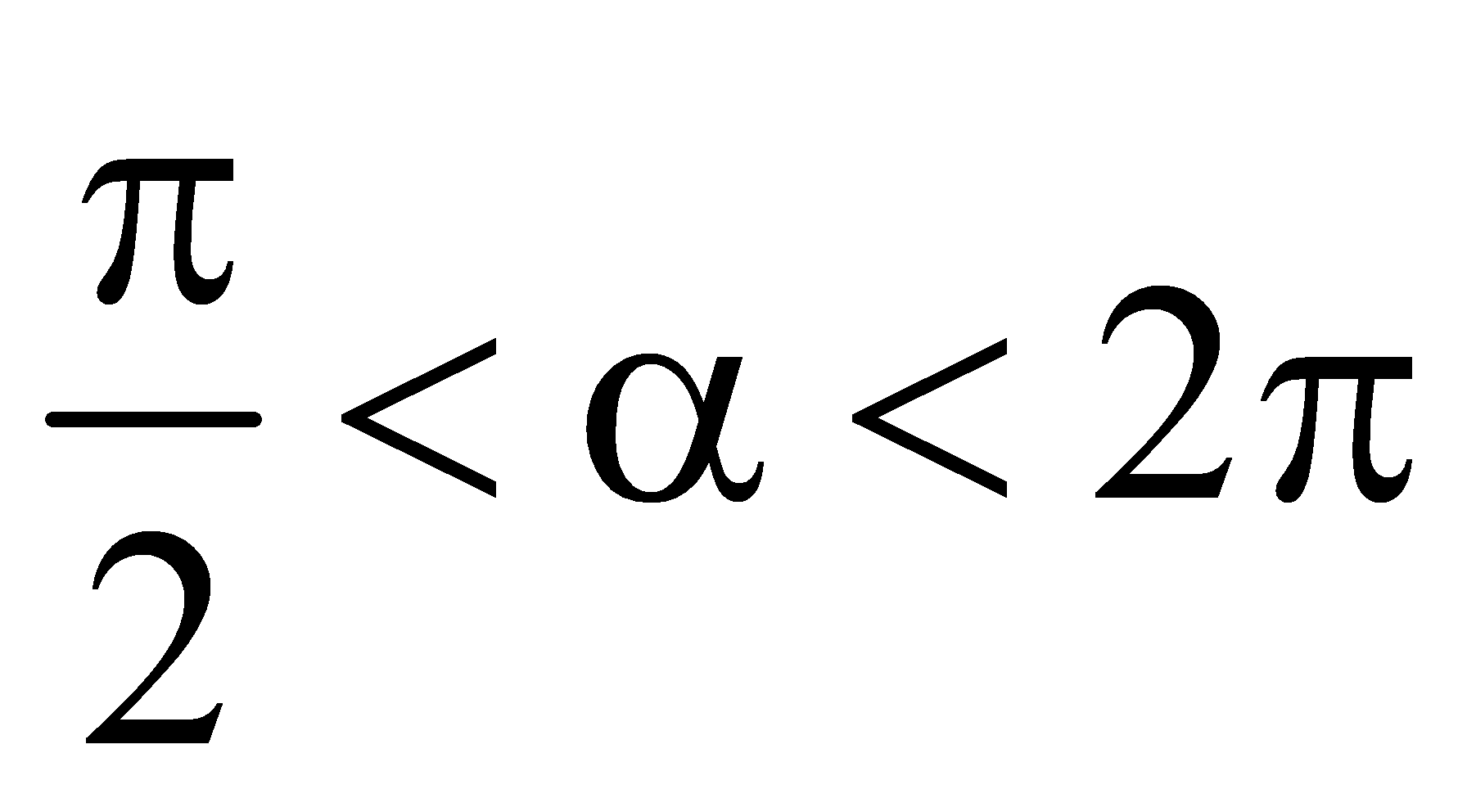 ,
, 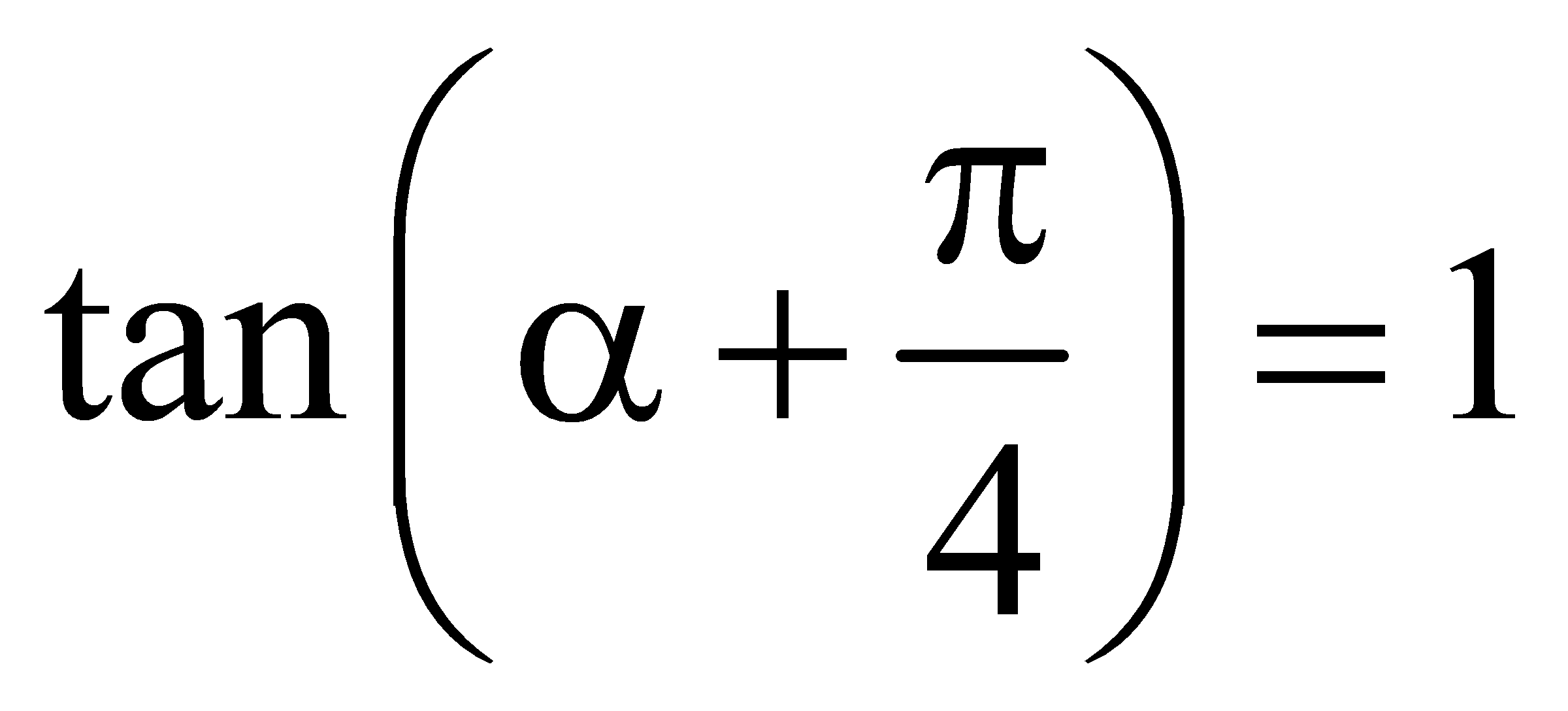 . Tính
. Tính 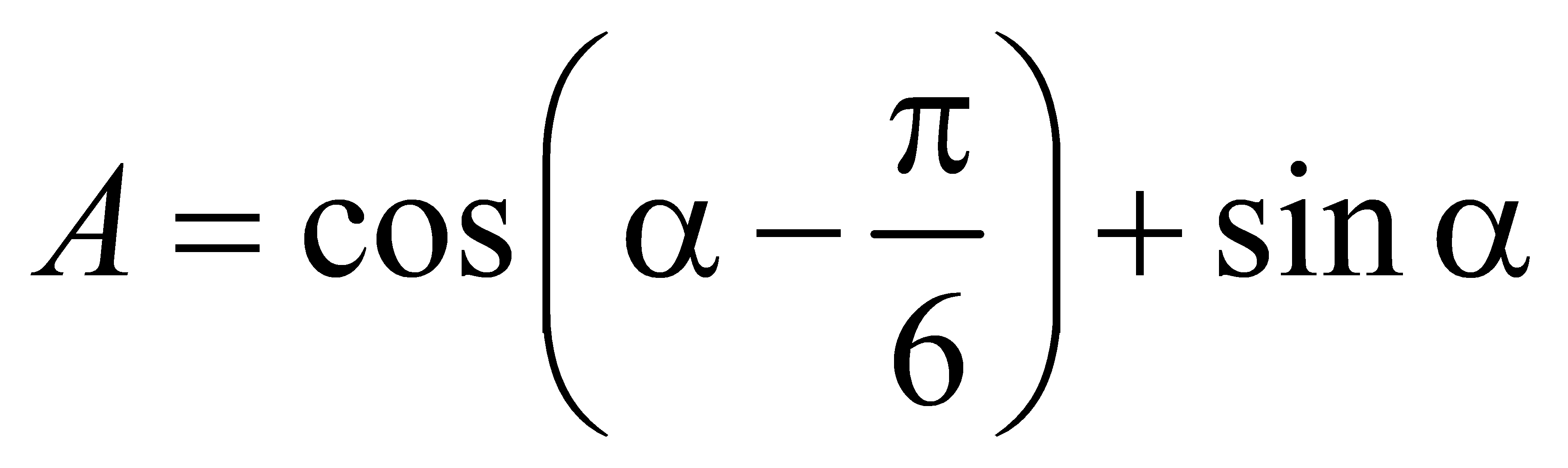 .
.