Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2, Cu, Fe(NO3)2 vào 400ml dng dịch HCl 1M thu đươc dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến các phản ứng xảy ra hoàn toàn đã dùng hết 580ml, kết thúc thu được m gam kết tủa và thoát ra 0,448 lít khí ở đktc. Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với
80
83
82
81
Nhận thấy khi thêm AgNO3 vào dung dịch Y sinh 0,01 mol NO chứng tỏ dung dịch Y chứa muối Clorua và HCl dư
→ nHCl dư = 4nNO = 4. 0,02 = 0,08 mol
→ nHCl pư = 0,4 - 0,08 = 0,32 mol
Vì HCl còn dư nên toàn bộ lượng NO3- trong Fe(NO3)2 chuyển hết thành khí NO
→ 2nFe(NO3)2 = nHCl pư : 4
→ nFe(NO3)2 = 0,32 :4:2 = 0,04 mol
Gọi số mol FeCl2, Cu và Ag lần lượt là x, y,z mol
Vì AgNO3dư nên ∑ nNO = nHCl : 4 = 0,1 mol
Bảo toàn electron cho toàn bộ quá trình :
nFeCl2 + 2nCu + nFe(NO3)2 = 3∑nNO + nAg
→ x+ 2y + 0,04.= 0,1. 3 + z
Kết tủa sinh ra gồm AgCl : 2x + 0,4 và Ag : z mol.
Bảo toàn nguyên tố Ag → 2x+ 0,4 + z= 0,58
Ta có hệ
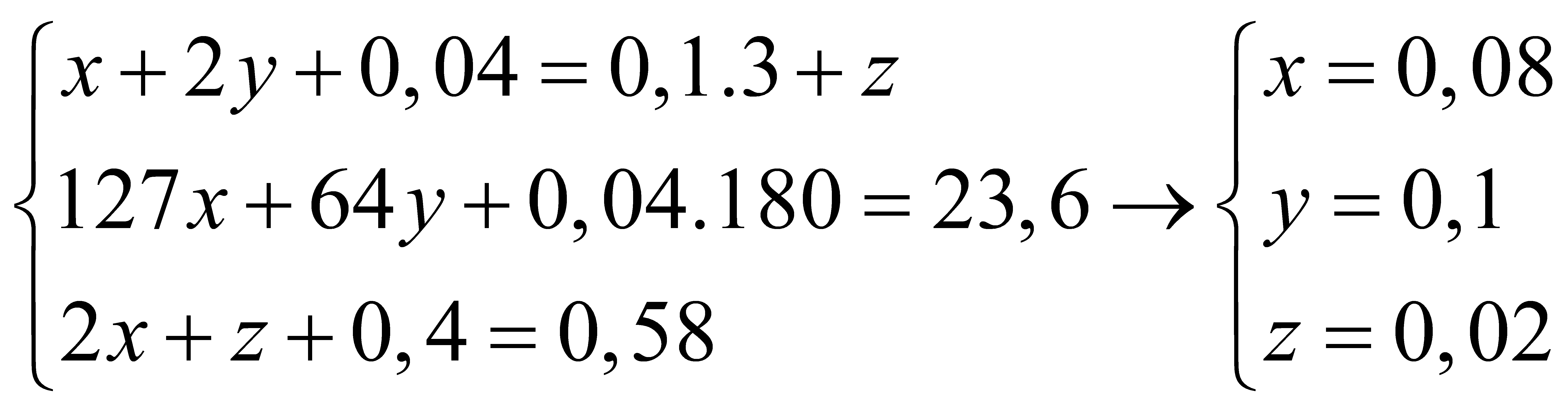
→ m↓ = 143,5. ( 2. 0,0 8+ 0,2) + 0,02. 108 = 82,52 gam.
Vậy đáp án đúng là B
