Điện phân dung dịch hỗn hợp chứa 0,04 (mol) AgNO3 và 0,05 (mol) Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là:
6,24 (gam).
3,12 (gam).
6,5 (gam).
7,24 (gam).
Định luật Faraday
m = ![]()
Trong đó:
+ m: khối lượng chất giải phóng ở điện cực (gam)
+ A: khối lượng mol của chất thu được ở điện cực
+ n: số electron trao đổi ở điện cực
+ I: cường độ dòng điện (A)
+ t: thời gian điện phân (s)
+ F: hằng số Faraday là điện tích của 1 mol electron hay điện lượng cần thiết để 1 mol electron chuyển dời trong mạch ở catot hoặc ở anot (F = 1,602.10-19.6,022.1023 ≈ 96500 C.mol-1)
Khi điện phân hỗn hợp dung dịch trên thì AgNO3 sẽ bị điện phân trước
MAg= mAg+= 0,04x108=4,32 g
Thời gian điện phân hết AgNO3 trong dung dịch là t= (mxnxF)÷ (AxI) = (4,32x 1x96500)÷(108x5) = 772 s
vậy thời gian để điện phân Cu(NO3)2 là 1930-772 =1158 s
Cu2+ +2e → Cu
Ta có mCu= 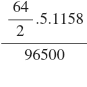 = 1,92 g
= 1,92 g
Vậy khối lượng kim loại bám vào catot là 4,32 + 1,92 = 6,24 g
